丂丂堢偰偨偄帒幙傗擻椡
侾丂揝偔偓偑偝傃傞條巕偺娤嶡傪捠偟偰丆帺慠奅偵偍偄偰偼恎偺夞傝偺傎偲傫偳偺暔幙偑嬻婥拞偺巁慺偲斀墳偟丆偝傃偰偄偔偲偄偆尒曽傗峫偊曽傪梴偆丅
俀丂揝偔偓偑偝傃傞梫場傪丆忦審惂屼偟側偑傜捛媶偡傞擻椡傪梴偆丅
丂丂妛廗偺億僀儞僩偲攝椂帠崁
侾丂偝傃偺偱偒傞嶰偮偺梫場乽悈乿乽巁慺乿乽怘墫乿偵偮偄偰丆偦傟偧傟偺梫場傪擖傟傞偐擖傟側偄偐偵拲栚偝偣側偑傜捛媮偝偣傞丅
俀丂僀僆儞偵偮偄偰偼妛廗偟側偄偺偱丆梡偄傞帋栻偵傛偭偰専弌偝傟傞僀僆儞偺愢柧偼帠慜偵峴偆丅
丂丂棟榑揑側攚宨
侾丂乽偝傃乿偲偼
丂嬥懏偺昞柺偼嬻婥傗悈側偳偲愙偟偰偄傞丅昞柺偺嬥懏尨巕偼揹巕傪幐偭偰梲僀僆儞偵側傝丆偝傜偵曄壔偟偰巁壔暔偵側傞丅
丂偙偺傛偆偵偟偰偱偒偨壔崌暔偑偝傃偱偁傞丅偝傃偵偼丆揝偺愒偝傃傗摵偺椢惵乮傠偔偟傚偆乯側偳偑偁傞丅
俀丂偝傃偲擱從偺堘偄
丂偝傃傕擱從傕巁慺偲壔崌偡傞巁壔斀墳偺堦偮偱偁傞丅偝傃偼偍偩傗偐側巁壔斀墳偱偁傞偑丆擱從偼擬傗岝傪偲傕側偆媫寖側巁壔斀墳偱偁傞丅
丂偝傃傕擬傪弌偟偰偄傞偺偩偑斀墳偑備偭偔傝側偺偱敪擬傪姶偠側偄丅
俁丂婱嬥懏
丂嬥懏偑偝傃傞偐偳偆偐偼丆偦偺嬥懏偑揤慠偵嶻弌偡傞忬懺傪尒傟偽暘偐傞丅
丂偝傃偵偔偄嬥丆敀嬥側偳偼嬥懏偺宍偱嶻弌偟丆偄偮傑偱傕旤偟偔曐偨傟偰偄傞丅
丂偙偺傛偆側嬥懏傪婱嬥懏偲偄偆丅懠偺傎偲傫偳偺嬥懏偼丆巁慺丆棸墿側偳偲壔崌偟偰峼愇偲偟偰嶻弌偡傞丅
係丂側偤偝傃傞
丂峼愇拞偵娷傑傟傞壔崌暔偐傜壔妛揑側張棟偵傛傝娨尦偟偰庢傝弌偟偨嬥懏偼丆帺慠奅偱偼嬌傔偰晄埨掕側懚嵼偱偁傞丅
丂偦偙偱丆嬥懏偼尦偺埨掕偟偨忬懺偵栠傠偆偲偡傞丅偙偺埨掕偟偨巁壔暔偺忬懺偵栠傠偆偲偡傞尰徾偑偝傃偱偁傞丅
俆丂揝偝傃偼偳偺傛偆偵偟偰偱偒傞
丂揝昞柺偺揝尨巕偼嬻婥拞偱悈偲愙偡傞偲丆揹巕傪幐偭偰揝乮嘦乯僀僆儞Fe2+偲側傝悈偵梟偗弌偡丅
丂幐傢傟偨揹巕偼悈偍傛傃巁慺偲斀墳偟丆悈巁壔暔僀僆儞OH-偲側傞丅
丂惗偠偨揝乮嘦乯僀僆儞偲悈巁壔暔僀僆儞偑斀墳偟悈偵梟偗側偄悈巁壔揝乮嘦乯Fe(OH)2偵側傞丅
丂丂

丂丂丂俥倕丂仺丂俥倕2+丂亄丂俀倕亅
丂丂丂俫2俷丂亄丂1/2俷2丂亄丂俀倕亅丂仺丂俀俷俫-
丂慡懱偺壔妛斀墳
丂丂丂俥倕丂亄丂俫2俷丂亄丂1/2俷2丂仺丂俥倕乮俷俫乯2
丂偝傜偵俥倕(俷俫)2偼悈偲巁慺偲斀墳偟偰俥倕(俷俫)3偵側傞丅
丂俥倕(俷俫)2丂亄丂1/2俫2俷丂亄丂1/4俷2丂仺丂俥倕(俷俫)3
丂愒偝傃偼俥倕(俷俫)3偑偝傜偵曄壔偟丆俥倕2俷3巶g2俷偵側偭偨傕偺偱偁傞丅
丂巁慺暘巕傗悈忲婥偼昞柺偵偱偒偨偝傃傪捠傝敳偗傞偙偲偑偱偒傞偺偱丆偝傃偼撪晹傑偱恑峴偡傞丅偒偢偑偮偄偨傝嬋偑偭偨傝偟偰偄傞晹暘偼尨巕偺暲傃曽偵傂偢傒偑偱偒偰偄傞偺偱偝傃偑恑峴偟傗偡偄丅
丂揝偑偝傃傞偲偒偺斀墳偼敪擬斀墳偱偁傞丅偙偺偲偒敪惗偡傞擬僄僱儖僊乕傪棙梡偟偨傕偺偑実懷梡僇僀儘偱偁傞丅
俇丂墫悈偑偮偔偲偝傃傞偺偼側偤偐
丂墫暘偵偼挭夝惈乮屌懱偑嬻婥拞偺悈暘傪媧偭偰梟偗傞尰徾乯偑偁傞偺偱丆偝傃偵昁梫側悈暘傪曐偮偙偲偑偱偒傞丅
丂偝傜偵丆娷傑傟傞墫壔暔僀僆儞Cl-偑偝傃偺恑峴傪懍傔傞怗攠偺摥偒傪偡傞丅椺偊偽丆奀娸嬤偔偱偼丆墫暘偺塭嬁偱偝傃偑恑峴偟傗偡偄丅
俈丂偝傃傪杊偖偵偼偳偆偡傟偽偄偄偺偐
丂(1) 揾椏
丂嫶丆慏丆幵側偳偼偝傃傗偡偄娐嫬偺拞偱棙梡偝傟傞偺偱丆儁儞僉摍偺揾椏傪揾偭偰丆偝傃傪杊偄偱偄傞丅
丂(2) 傔偭偒
丂偝傃偵偔偄嬥傗嬧側偳偺嬥懏偱昞柺傪暍偆偙偲偵傛傝嬥懏傪曐岇偡傞丅偙偺曽朄傪傔偭偒偲偄偆丅
丂悈摴偺幹岥偵偼揝偵僋儘儉偑丆壆崻側偳偵巊傢傟偰偄傞僩僞儞偵偼揝偵垷墧偑丆娛媗側偳偵巊傢傟偰偄傞僽儕僉偵偼揝偵僗僘偑傔偭偒偝傟偰偄傞丅
丂(3) 昞柺張棟
丂傾儖儈僯僂儉偼旕忢偵斀墳偟傗偡偄嬥懏偱偁傞偑丆鉱枾偱敄偄巁壔旐枌偵傛傝撪晹偑曐岇偝傟偰偄傞偺偱乮晄摦懺乯丆旤偟偄嬥懏岝戲傪曐偮偙偲偑偱偒傞丅
丂傾儖儈僯僂儉惢昳偼丆恖岺揑偵巁壔旐枌傪偮偔傞張棟乮傾儖儅僀僩壛岺乯傪偟偰偝傃偵偔偔偟偰偄傞丅撿晹揝側偳偼昞柺傪崟偄揝偺巁壔暔Fe3O4偺旐枌偱暍偆偙偲偵傛傝撪晹傪曐岇偟偰偄傞丅
俉丂偝傃側偄揝偑偁傞偐
丂偝傃側偄揝偺惢憿偼恖椶偺挿偄柌偱偁偭偨偑丆19悽婭偺枛偵丆揝偵僋儘儉偲僯僢働儖傪壛偊偨崌嬥偱偁傞僗僥儞儗僗峧偑奐敪偝傟偨丅
丂僗僥儞儗僗峧偑偝傃偵偔偄偺偼丆昞柺偵僋儘儉偺巁壔旐枌偑偱偒傞偨傔偱偁傞丅尰嵼棙梡偝傟偰偄傞嬥懏偺懡偔偼崌嬥偲偟偰梡偄傜傟偰偄傞丅
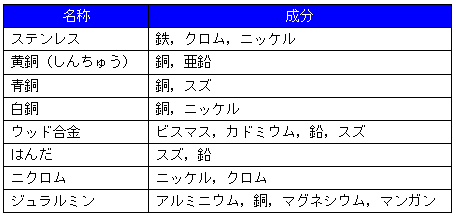
俋丂崌嬥偺庬椶
丂丂丂