丂丂堢偰偨偄帒幙傗擻椡
僀僆儞壔孹岦偺堎側傞嬥懏傪揹夝幙偺梟塼偵擖傟偰摫慄偱寢傇偲揹婥偑婲偒傞偲偄偆尒曽傗峫偊曽傪堢偰傞丅
丂丂妛廗偺億僀儞僩偲攝椂帠崁
侾丂偄傠偄傠側嬥懏傪弨旛偟丆偳偺嬥懏偺慻傒崌偣偺応崌偵婲揹椡偑戝偒偄偐挷傋偝偣傞丅
俀丂婓棸巁摍偺栻昳擹搙偺妋擣傗庢埖偄曽偺愢柧傪朰傟側偄傛偆偵偡傞丅
丂丂棟榑揑側攚宨
侾丂揹抮
丂揹抮偼丆巁壔丒娨尦斀墳傪棙梡偟偰壔妛曄壔偺僄僱儖僊乕傪揹婥僄僱儖僊乕偵曄偊傞憰抲偱偁傞丅
俀丂儃儖僞揹抮
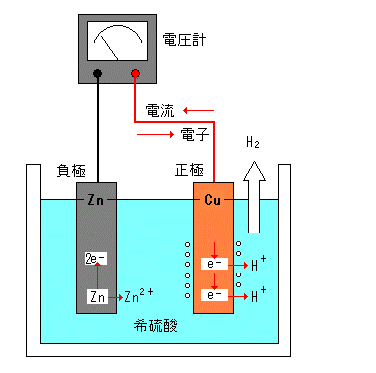
丂1800擭丆僀僞儕傾偺暔棟妛幰偱偁傞儃儖僞偑俀庬偺嬥懏偺僀僆儞壔孹岦偺嵎傪棙梡偟偰敪柧偟偨偙偺儃儖僞揹抮偼丆嵟弶偺堦師揹抮偲偟偰揹婥壔妛偺尋媶丒敪揥偵峷專偟偨丅僀僆儞壔孹岦偺戝偒偄垷墧偑僀僆儞偲偟偰梟偗弌偡偙偲偵傛傝丆垷墧斅偵巆偭偨揹巕偼丆摫慄傪捠偭偰摵斅偵堏摦偡傞丅
丂丂丂乮晧嬌偱偺斀墳乯倅値丂仺丂倅値2+丂亄丂俀倕-
摵斅偵堏摦偟偨揹巕傪摵斅晅嬤偺悈慺僀僆儞偑庴偗庢傝丆摵斅晅嬤偐傜悈慺偑敪惗偡傞丅
丂丂丂乮惓嬌偱偺斀墳乯俀俫+丂亄丂俀倕-丂仺丂俫2
丂婲揹椡偼嵟弶栺1.1倁偱偁傞偑丆摵斅偺昞柺傪悈慺偺婥朅偑偍偍偆偙偲偵傛傝丆悈慺僀僆儞偑揹巕傪庴偗庢傝偵偔偔側傝丆傗偑偰婲揹椡偑掅壓偡傞乮暘嬌尰徾乯丅
丂暘嬌傪杊偖偨傔偵偼丂夁巁壔悈慺悈側偳乮尭嬌嵻乯傪壛偊傞偲婲揹椡偼尦偵栠傞丅
丂丂丂俫2丂亄丂俫2俷2丂仺丂俀俫2俷
俁丂僟僯僄儖揹抮
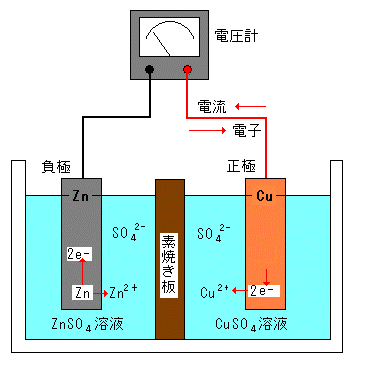
丂1836擭丆僀僊儕僗偺暔棟妛幰偱偁傞僟僯僄儖偑暘嬌偺惗偠側偄僟僯僄儖揹抮傪敪柧丅僀僆儞壔孹岦偺戝偒偄垷墧偑僀僆儞偲偟偰梟偗弌偡偙偲偵傛傝丆垷墧斅偵巆偭偨揹巕偼丆摫慄傪捠偭偰摵斅偵堏摦偡傞丅
丂丂丂乮晧嬌偱偺斀墳乯倅値丂仺丂倅値2+丂亄丂俀倕-
丂摵斅偵堏摦偟偨揹巕傪摵斅晅嬤偺摵(嘦)僀僆儞偑庴偗庢傝丆摵偑愅弌偡傞丅
丂丂丂乮惓嬌偱偺斀墳乯俠倳2+丂亄丂俀倕-丂仺丂俠倳
丂悈慺偺敪惗偑側偄偺偱暘嬌偼婲偙傜側偄丅
俆丂儅儞僈儞姡揹抮偺峔憿
丂姡揹抮偼丆揹抮偺揹夝塼傪屝忬偵屌傔偰枾暵偟丆巊偄傗偡偔偟偨幚梡揹抮偱偁傞丅傛偔巊傢傟傞姡揹抮偵丆儅儞僈儞姡揹抮偑偁傞丅
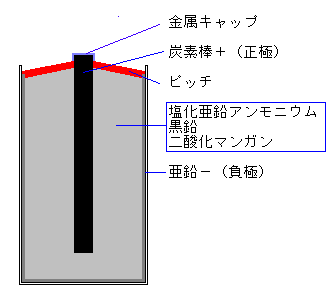
丂垷墧梕婍偼晧嬌偲側傝丆巊梡帪偵偼斀墳偟偰垷墧僀僆儞偵側傞丅惓嬌偺扽慺朹偱偼丆擇巁壔儅儞僈儞俵値俷2偑傾儞儌僯僂儉僀僆儞俶俫4+偲斀墳偟偰娨尦偝傟傞丅
丂偙偺偲偒丆擇巁壔儅儞僈儞偲垷墧偑捈愙愙怗偡傞偲丆揹巕偼愙怗偟偨晹暘偱棳傟偰偟傑偄丆奜晹偺夞楬偵揹巕傪棳偡偙偲偑偱偒側偄偺偱丆姡揹抮偱偼捈愙愙怗偟側偄傛偆偵摿庩側巻偑梡偄傜傟偰偄傞丅
俇丂旛挿扽揹抮
丂傾儖儈僯僂儉偼偔傪姫偄偨旛挿扽揹抮偼丆扽偑惓嬌偱丆傾儖儈僯僂儉偼偔偑晧嬌偵側傞丅
丂晧嬌偱偼傾儖儈僯僂儉偑傾儖儈僯僂儉僀僆儞偲偟偰梟偗弌偟丆惓嬌偱偼扽偵媧拝偟偰偄傞巁慺偑揹巕傪庴偗庢傞丅
丂丂丂晧嬌丂丂俙倢丂仺丂俙倢3+丂亄丂俁倕-
丂丂丂惓嬌丂丂1/2俷2丂亄丂俀俫2俷丂亄丂俀倕-丂仺丂俀俷俫-
丂旛挿扽偼枾搙偑戝偒偔丆揹棳傪棳偡偙偲偑偱偒傞丅栘扽傗抾扽偼揹棳傪棳偝側偄偨傔揹抮偵偼側傜側偄丅
