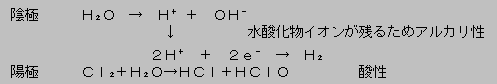育てたい資質や能力
化学反応により電気エネルギーが得られる電池に対して電気分解は電気エネルギーにより化学反応が起こることから,双方向の反応とイオンの理解とエネルギー保存についての見方や考え方を養う。
学習のポイントと配慮事項
1 いろいろな水溶液を準備し,観察,実験を行い比較することにより共通性を見いださせるようにする。
2 電流を流した時間と発生する気体の量を関係付けさせる。
理論的な背景
1 電気分解
電解質の水溶液に電流を流すと,化学変化が起こる。これを電気分解という。
陰極では,陽イオンが電子を受け取る反応が起こる。(還元反応)
陽極では,陰イオンが電子を与える反応が起こる。(酸化反応)
2 水溶液の電気分解による陽極・陰極での生成物
〈陽極〉
硝酸イオンや硫酸イオンは水の電離によって生じる水酸化物イオンより安定なため,水酸化物イオンが陽極で電子を与え酸素ガスが発生する。
4OH- → 2H2O + O2 + 4e-
水酸化物イオンや塩化物イオンは陽極で電子を与え,酸素ガスや塩素ガスが発生する。
4OH- → 2H2O + O2 + 4e-
2Cl- → Cl2 + 2e-
※電解液中の陰イオンの安定度
硝酸イオン,硫酸イオン>水酸化物イオン>塩化物イオン
〈陰極〉
イオン化傾向が水素より大きな金属のイオンは水の電離によって生じる水素イオンより安定なため,水素イオンが陰極で電子を受け取り,水素ガスが発生する。
2H+ + 2e- → H2
イオン化傾向が水素より小さな銅や銀のイオンは陰極で電子を受け取り,析出する。
Cu2+ + 2e- → Cu
Ag+ + e- → Ag
※イオン化列(イオン化傾向の大きなものから並べたもの)
K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
3 食塩水の電気分解
食塩水を電気分解すると陰極から水素ガスが,陽極から塩素ガスが発生し,水溶液中のナトリウムイオンが電子を受け取ってナトリウムとして析出することはない。
陰極付近では,ナトリウムイオンの代わりに水が電離して生じる水素イオンが電子を受け取る。よって,溶液中の陰極付近には水酸化物イオンが残り(アルカリ性),陽極付近は塩素が溶けた塩素水(酸性)となっている。
この反応を,食塩水にフェノールフタレインやBTB溶液を加えて電気分解することにより確認できる。