簡易ユージオメーターを使って水の合成実験をすると,大きい音を立てて激しく燃えるのは観察できるのですが,下の水槽から水が上がってきて,水ができたことを確認できません。水ができたことを確認できる水の合成実験はありませんか。
A
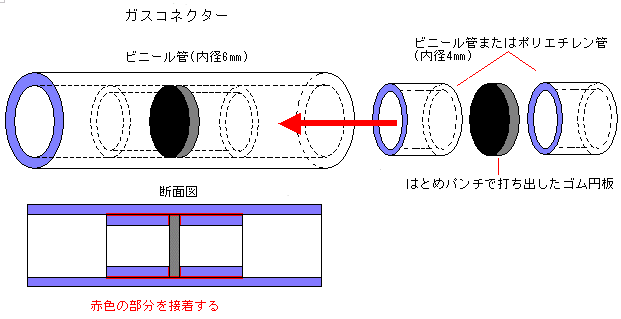
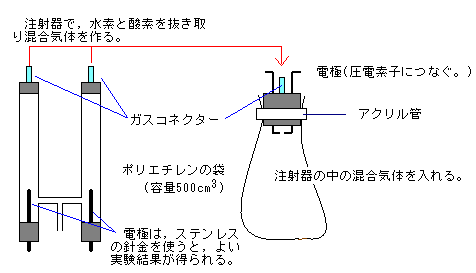
水は水素と酸素の化合物であるということを確認させるためには,水の合成実験は欠かせません。できれば,水の電気分解に続いて水の合成実験を行いたいものです。そこで,ガスコネクターを使った実験を紹介します。この方法なら,生徒でも行えます。
水素と酸素を抜き取るとき,ガスコネクターに注射針を刺して抜き取るので,注射器の取扱いについてはしっかりと事前指導を行う必要があります。
Q19
鉄と硫黄を化合させる実験で,反応後の物質も磁石に付いてしまうのですが,どのようなことに気を付ければよいのですか。
A
鉄と硫黄がよく混ざっていないと,未反応の鉄が残ってしまい,反応後も磁石に付いてしまいます。次のことに気を付けて,実験の準備を行ってください。
○ 鉄と硫黄の分量を守る。鉄が多いと当然,未反応のものが残ってしまう。硫黄はやや多めでも構わない。
○ 鉄と硫黄を乳鉢と乳棒でよく混ぜる。鉄と硫黄がまんべんなく接するよう,乳鉢の底に硫黄の黄色の線が残らなくなるまですりつぶす。
○ 鉄と硫黄の混合物は,アルミニウムはくで作った筒に固く詰める。アルミニウムはくで作った筒の下部を,机にトントンと当てながら詰めていくとよい。この詰め方がよくないと,反応の途中でアルミニウムはくで作った筒が破裂することがある。
Q20
「燃焼では,物質が酸素と化合している」ということを実感させられるような実験はありませんか。
A
生徒は,物質が燃えると質量が小さくなると考えています。また,物質が燃えると必ず二酸化炭素が発生すると考えている生徒も多いようです。これらの誤解は,「化学変化では原子同士のやりとりが起こっている」ということを,ドルトンの原子説やアボガドロの分子説を学んだ後であっても理解していないことを示しています。
燃焼の指導では,質量保存の法則まで考慮した次のような指導を行うとよいでしょう。
① 様々な物質を燃焼させる。元の物質よりも質量が小さくなる場合と大きくなる場合があり,燃えて気体が発生する場合は質量が減少し,気体が発生しない場合は質量が増加することを確認させる。
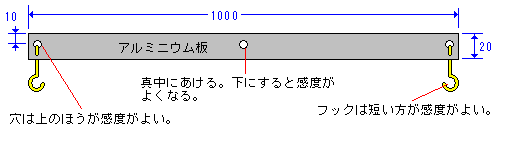
スチールウールが燃えて,質量が大きくなる現象を事象提示したい場合は,吉田南中学校で開発した大型てんびんを用いるとよい。てんびんの作り方を下図に示す。極細の鉄線でできている000番のスチールウールをほぐして広げた後,そのスチールウールを両側のフックに釣り合うように下げる。一方のスチールウールに火を付けると,徐々に燃え広がりながら,燃えているスチールウールの方が下がっていく。
② 酸素が100%入った集気瓶,酸素が20%,窒素が80%の混合気体が入った集気瓶,窒素が100%入った集気瓶のそれぞれに,火の付いたスチールウールを入れ,燃える様子を観察させる。この実験から,スチールウールが燃えて質量が大きくなるのは,空気中の酸素が化合するからだということを導き出させる。
③ 酸素の入った丸底フラスコ内でスチールウールを燃焼させて,変化の前後で質量が変わらない様子を観察させ,その理由を原子・分子のモデルで考察させる。
④ 有機物の燃焼を原子・分子モデルで考えさせ,「閉鎖系で実験すると質量は変わらないだろう」という予想を立てさせる
⑤ プラスチックの容器,石灰石,薄い塩酸を用いて,閉鎖系での気体発生実験を行い,変化の前後で質量が変わらないことを確認させる。
これらの実験に加えて,生徒にとって意外性のある,マグネシウムが二酸化炭素中で燃える現象を観察させると,生徒は酸素の挙動に目を向け,燃焼の定義について理解を深めさせることができます。
Q21
マグネシウム粉末や銅粉末を熱し続けて酸素と化合させる実験で,加熱を繰り返してもなかなか質量が一定にならず,一定になったとしても理論値からかけ離れたデータになってしまいます。何か良い方法はありませんか。
A
この実験は,加熱と秤量を繰り返し,ある一定質量になるとそれ以上質量は増えないという結果から,定比例の法則を導くために行います。この実験の問題点は次のようなものです。
○ 未反応のマグネシウムや銅が残るため,酸化率が低くなる。
○ 粉末のマグネシウムを使うと,酸化マグネシウム以外に黄色の窒化マグネシウムができるときがある。
○ マグネシウムリボンを使うと,白煙となって散逸する酸化マグネシウムが多くなるとともに,ステンレス皿上の加熱では,未反応のマグネシウムが多く残る。
○ 加熱→冷却→秤量を何度も繰り返すため,時間がかかり過ぎる。
これらの問題点を解決するためには,「できるだけ細かい粉末を使う」,「極めて強い火力で加熱する」,「粉末をすりつぶすようによくかき混ぜる」などの工夫が考えられますが,なかなか期待する値が得られません。特にマグネシウム粉末を使った実験は,うまくいきません。(銅粉末を使った実験では,0.5g以下の銅粉末を強熱するとうまくいく場合があります。)
マグネシウムを使って酸化率を上げるには,次のような方法があります。
① ステンレス皿は,あらかじめ赤熱するまで加熱した後,放冷しておく。

② ステンレス皿とステンレス金網を合わせた質量を量る。
③ マグネシウムリボンの表面を,紙やすりでよく磨き,渦巻き状に巻く。
④ 渦巻き状に巻いたマグネシウムリボンをステンレス皿に入れ,質量を測定する。
⑤ マグネシウムリボンを入れたステンレス皿に,散逸防止用のステンレス金網を載せ,その上に蝶(ちょう)ナットを取り付けたステンレス皿でふたをする。このとき,下の皿とふたは少しずらして,1.0㎜程度のすき間を作る。
ふたをするのは,加熱の際,温度を早く発火点まで上げるためである。

⑥ ⑤を強熱する。
⑦ マグネシウムが発火したら,ふたを取る。(発火したかどうかは,ふたのすき間から白煙がわずかに出ることで分かる。)
⑧ 実験用ボンベを使って,金網の上から酸素を穏やかに供給する。
⑨ 明るい発光部分がなくなったら,ステンレス皿を鉄板上に移し,冷却する。
⑩ 冷えたら,ステンレス皿と金網を合わせた質量を量る。
〈実験結果〉
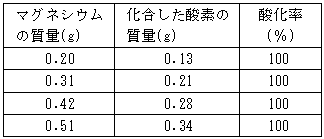
※ マグネシウムの質量が多くなると,燃焼による発熱が大きくなり,酸素を供給するのは危険である。
⑪ 再度加熱,冷却して質量を量り,質量が増加しないことを確認する。
この実験では,穏やかに酸素を供給するのが難しいので,教科書に示されている実験を行った後,確認のための演示実験として取り扱うのが適当でしょう。