|
1 研究に取り組んだ観察,実験(6 エネルギー)
1分野下 エネルギー(化学カイロによる化学エネルギー)
2 観察,実験のねらい 鉄が酸化すると起こる発熱反応を体験させ,化学変化によって物質がもっていた化学エネルギーが熱エネルギーに変換されることを気づかせる。
3 観察,実験の実際 ① 鉄粉と活性炭を混ぜ,そのときの温度を確認する。 ② 食塩水を数滴たらし,ガラス棒でよくかき混ぜながら,1分ごとに温度をはかる。 * 活性炭の役割:・多孔質であるため空気中の酸素を吸着して酸素濃度を高める。 ・食塩水を保持するための保水剤にもなる。 ・さらさらとした細かい粒子で,鉄粉を広げ空気中の酸素や食塩とよく接触でき るようにする。 * 食塩の役割:触媒として作用し,反応を促進する。 * 水の役割:食塩が全体にまんべんなく広がり,鉄と触れ合いやすくする。
4 問題点 指導書では,50℃以上温度が上昇するように書かれているが,実際に実験をすると10℃程度しか上昇しなかった。 その原因は,鉄粉の状態(開封後の保存期間が長く酸化が進んでいる)や鉄粉の粒子の大きさではないかと考えた。
5 観察,実験のポイント(明らかにしたいこと) 教科書の方法は,「数滴」という食塩水の量が曖昧であるため,次のような方法(おもしろ実験・ものづくり辞典 左巻健男 他著 参考)に統一して行った。その上で,(1)~(3)について調べた。 実際の実験方法 ① 100mlビーカーに活性炭3gをはかりとり,5%食塩水を2ml加えよくかき混ぜてそのときの 温度を確認する。 ② ①に鉄粉6gを加えてガラス棒でかき混ぜ,1分ごとに温度をはかる。
(1) 開封直後の鉄粉と開封後長期保存した鉄粉で温度上昇のちがいを比較する。 (2) 粒子の大きさによる温度上昇のちがいを比較する。 (3) 触媒である食塩水の濃度による温度上昇のちがいを比較する。
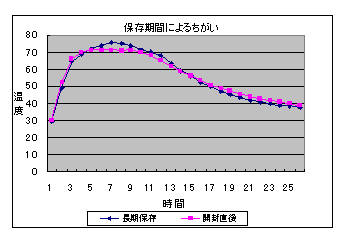
6 結果(上昇した温度) (1) 鉄粉の保存期間による比較(食塩水の濃度 5%)
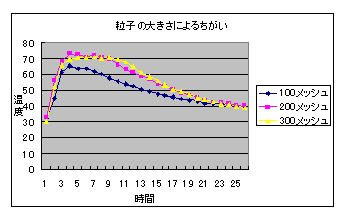
(2) 粒子の大きさによる比較(食塩水の濃度 5%)
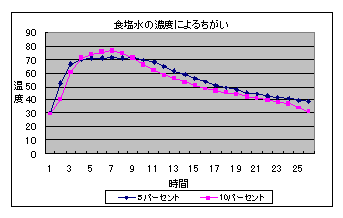
(3) 食塩水の濃度による比較(300メッシュ)
7 考察 (1) 「開封後長期保存の鉄粉」は,「開封直後の鉄粉」より黒っぽくなっており,保存中既に表面が酸化されているように見えた。しかし,温度変化にはあまり影響がないようだった。 (2) 100メッシュは,200・300メッシュに比べると温度上昇が小さいが,十分発熱を確認できる程度である。 (3) わずかに10%食塩水を用いた方が温度上昇は大きいがあまり差は見られない。
以上の結果より,温度がわずかしか上がらない原因がわからなかった。そこで,実際に授業で行った方法をもう一度振り返り,原因を再度考えた。 ・ 「5%食塩水数滴」を10滴以下と捉えていたため,食塩水の量が不足していたのではないか。 ・ はじめに活性炭と鉄粉を混ぜてから食塩水を加えたため,十分全体にいきわたらず反応が促進されなかったのではないか。 ・ 100mlビーカーではなくフィルムケースを用いたため,酸素が十分供給されなかったのではないか。
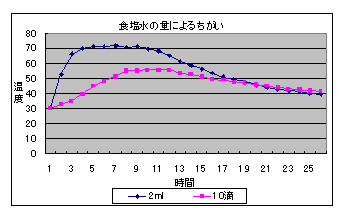
8 再実験 (1) 濃度は変えず,食塩水の量による温度上昇の違いを比較する。 (2) はじめに活性炭と鉄粉を混ぜてから食塩水を加えて行う。 (3) 容器(ビーカーとフィルムケース)による温度上昇の違いを比較する。 9 再実験の結果 (1) 食塩水の量による比較(5%食塩水,300メッシュ)
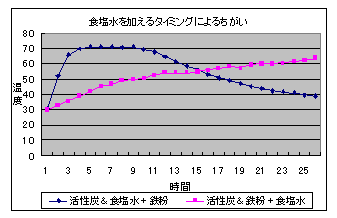
(2) 食塩水を加えるタイミングによる比較(5%食塩水2ml,300メッシュ)
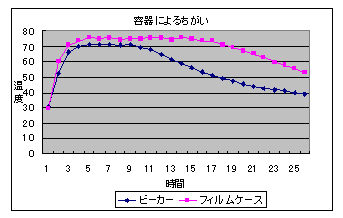
(3) 容器の違いによる比較(5%食塩水2ml,300メッシュ)
10 再実験の考察 (1) 10滴のでも温度上昇は確認できるが,量が十分ではないようで温度上昇が小さかった。 (2) あらかじめ活性炭に食塩水をしみ込ませた後鉄粉を加える方法は,食塩が満遍なくいきわたる ため温度上昇が早く,短時間で温度上昇を確認できる。活性炭と鉄粉の混合物に食塩水を加える方 法では,食塩が鉄粉全体にいきわたりにくいため反応速度が遅いようである。しかし,ある程度温度の高い状態を長時間持続することができる。 (3) ビーカーの方が口が広いため酸素が十分供給されて反応が早くなるのではないかと考えていたが,むしろ少しではあるがフィルムケースの方が温度上昇が大きかった。
温度上昇が小さい原因は1つではなく,いくつかの要因が相互作用しているのではないかと思う。特 に,触媒である食塩水の量が少ないと鉄粉がなかなか酸化されず温度が上がらない。短時間で発熱を確 認するには,「粒子の小さい鉄粉を用いる」,「触媒として十分な量の食塩水を加える」,「活性炭にあら かじめ食塩水をしみこませた後,鉄粉を加える」という条件を満たせばよいという結論に至った。 (さつま町立山崎中学校 星野 由美子) |