|
���a�H��Ȑ��̍�}
�P�@�����Ɏ��g�ώ@�C���� ���a�H��Ȑ��̍�}�i���k�P�l�ЂƂ肪�������s���鏭�ʎ����ł̕��@�̌����j �Q�@�ώ@�C�����̂˂炢 ���a�H��Ȑ����C������ʂ��č�}�����C���a�H��Ȑ��̓����𗝉�������B �R�@�ώ@�C�����̎��ۂƖ��_ ���a�H��Ȑ��́C�_����̒��a�����̍ہC�����n�t���̂��g�ω����C�H���ʂƋ��Ɏ������O���t�ł���B�p����_�C����̋���ɂ�蓾����Ȑ��͗l�X�����C�T���Ē��a�_�t�߂ł́C���g���}���ȕω���������Ƃ�������������B�ʏ�C���̋Ȑ��Œ��a�_�O��̓������킩�邱�ƂŎ�������̒��ӓ_�i���a�_�t�߂ł́C�H�����P�H���T�d�ɍs���ׂ��Ƃ������Ɓj���c���ł��C�܂����a�H��ł̓K�Ȏw����̔��f�ޗ��Ƃ���B�Ƃ��낪�C���̋Ȑ��̕`���O�Ղ͓Ɠ��ł��邽�߂��C���k�͂��܂藝����[�߂��Ȃ��B�����ŁC�������s���C�Ȑ���`������C����x�������Ǝv���邪�C�����ɂ͈ȉ��̖��_�����݂���B
�@�ɂ��ẮC���t�������ōs���C���k�ɂ̓v���W�F�N�^�[���Ŏ������@������Ǝv�����C���k�������炪������C���������ʂł͂Ȃ��̂ŁC���k�̗���x�⋻���S�����߂邱�Ƃɂ͌��т��Ȃ��̂ł͂Ȃ����B �A�ɂ��ẮC�@�ł̉������͐��k�̊��������҂ł��邪�C�ʂ����đS�Ă̐��k�������C���ʂ����Ƃ��ł���̂��B
�S�@�ώ@�C�����̉��P�̃|�C���g�C�J���������ދ��� ������ϋɓI�ɍs�����Ƃ́C�����S�����߂邾���łȂ��C�Ȋw�I�Ȏv�l�͂�{�����߂ɑ厖�Ȃ��Ƃł���B���̂��߁C���́C�P�l�ЂƂ肪�����́u��̎ҁv�ƂȂ��悤�ȕ��@���l���Ă݂��B �܂��C���a�H��Ȑ���`�����߂̎������u�ł���B���ʂ͒��a�H��Ɠ��l�́C�r�����b�g�C�R�j�J���r�[�J�[�C�z�[���s�y�b�g�C���X�t���X�R�Ƃ������������K�v�ƂȂ�i�ʐ^�P�j�B�������C�w�Z�ŏ������Ă�����́C���ʂ͑����Ă��Q�l�ɂP�Z�b�g���x�ł���̂��قƂ�ǂł͂Ȃ����낤���B�����ŁC����C�r�����b�g�ƃR�j�J���r�[�J�[�̑���Ƃ��āC�_��r�Ɣ����M�������Ă݂��i�ʐ^�Q�j�B�����͔�r�I�����ł��邽�߁C���k��l���ւ̏������\�ł���B�܂��C�_��r�̓r�����b�g�Ɠ��l�C�H���ɂ�锽�����ł���B�����Ĕ����M�ƃZ�b�g�ŗp���邱�Ƃɂ��C���ʂł̎������\�ł���C������̔p�t�����������Ȃ��čςޗ��_������B
���ɁC���g�̑�����@�ł���B���m�ȑ�����s�����߂ɂ́C�O�q�̂Ƃ��肐�g���[�^�[���K�v�ł��邪�C����̓��j�o�[�T�����g�������i�ʐ^�R�j��p�����B����ł��邐�g�͈͂͂��g�P�`�P�P�ŁC���ʉ\�Ȃ��g�͂P���݂ł��邽�߁C���g�̑���͂��u�A�o�E�g�v�ł͂��邪�C����́u�������s���C�H��Ȑ��������v�Ƃ����ړI�ł���C�Ó��ł͂Ȃ����Ɣ��f�����B �܂��C�r�����b�g��_��r�ɑウ�Ď������s���ɂ́C�P�̖�肪���݂���B�r�����b�g�͓H����������̑̐ς��C��ǂ̖ڐ���œǂݎ��B�������_��r�ł́C�H�������n�t�̑̐ς�ǂݎ�邱�Ƃ͂ł��Ȃ��B�ʏ�C�H��Ȑ��͏c���ɂ��g�C�����ɓH���ʁi�̐ρj������}���邽�߁C�ǂ�����悢���B�������C�r�����b�g�͊������J�����Ƃɂ�莎��͏d�͂ɂ�莩�R�H���ƂȂ邪�C�_��r�͂��̍\����C�����ŕr�̖{�̂������H�������邽�߁C�������ɂ����肵���H���������邩���^��ł���B�����ŁC�_��r�ɂ��āC�ȉ��̌������݂��B ���؎����F�_��r�̓r�����b�g�̑���ƂȂ邩�B ���@�@���F�_��r����H�������P�H������̑̐ς��C���̎��ʂ���Z�o�ł���C�H�������n�t�̓H���~�P�H������̑̐ρ��H�������n�t�̑̐��ƂȂ�C�r�����b�g�̑���ƂȂ�̂ł͂Ȃ����B ��������F�@�_��r�ɏ��������C�r�[�J�[�ɂP�O�H���H�����C���ʂ�d�q�V�т�ő��肷��i�ʐ^�S�j�B �A�P�O�H���̎��ʂ𑪒肵�C�P�H������̕��ϒl���Z�o���C��r����B ���،��ʁF
�\�P�@�_��r�̓H���ʂƎ��ʂƂ̊W
�\�Q�@�r�����b�g�̓H���ʂƎ��ʂƂ̊W �T�O�H�܂ł̒l�Ŕ�r�������ʁC�l�ɂ���͂�����̂́C�قڂP�H�������O�D�O�U���ƂȂ�i�\�P�j�B�����̔�d�͂P���^�����ł��邽�߁C�_��r�P�H������̎��ʂ͂O�D�O�U�����ƂȂ�B�r�����b�g�ɂ��ē��l�̎������s�������ʁC�P�H������O�D�O�T�����ƂȂ����i�\�Q�j�B���_�Ƃ��āC�r�����b�g�̑���ɓ_��r��p���Ă������x���Ȃ��C�����͐������Ɣ��f�����B �܂��C����̌��ł͏�����p���Ă��邪�C���ۂ̎����ł͗n�t��p���邽�߁C��d���قȂ邱�Ƃ��S�z����邪�C�n�t�ł���Ζ����ł���Ƃ��āC�P�H������O�D�O�U�����ōl���Ă������ƂƂ���B
�ȏ�̂��ƂȂǂ���C�����ɂ��Ă͈ȉ��̂Ƃ���ōs�����ƂƂ����B �����F�_��r�C�����M�C���g�������C��F�\�C�O�D�P�������^�����_�C�O�D�O�Q�������^�����_���i�g���E�����n�t ����F�@�@�_��r�ɉ��_�C���_���i�g���E�����n�t�����ꂼ������B �A�@���_���M�ɂP�H���C�P�O�����̂��ڂ݂ɓH������i�ʐ^�T�j�B �B�@�A�̔����M�ɐ��_���i�g���E�����n�t���C���߂̂��ڂ݂ɂ͂P�H�C���ɂ͂Q�H�C����Ƃ����悤�ɓH������i�ʐ^�U�j�B �C�@�����M�̂��ڂ݂ɂ��g��������Z���C����ꂽ�F�Ɣ�F�\�ł��g�f����i�ʐ^�V�j�B �D�@���_���i�g���E�����n�t�̓H���ʁC���g�̊W����}����B
�T�@���؎��Ƃ̗���ƌ��ʋy�эl�@ �܂����؎��Ƃ��s���Ă��Ȃ����߁C�ȉ��ɗ\�������̌��ʂ���ю��Ƃ��s���ۂ̗���������B
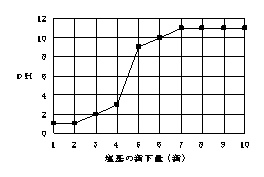
�y�\�������z �������ʁF
����ꂽ�H��Ȑ��F����ꂽ�H��Ȑ��͈ȉ��̂Ƃ���ł���C�ǂ����ʂł������B
�y���Ƃ̗���i�āj�z
�U�@���؎��Ƃ̐��ʂƉۑ� �y�ۑ�_�z �E���؎��Ƃɂ��ẮC����s�������B �E����̌����ł́C�H��Ȑ��̊�{�ƂȂ鋭�_�|������̏ꍇ�����������Ȃ������B��_��㉖��Ƃ̑g�ݍ��킹�ɂ��Ă��s����͂��ł��邽�߁C�X�Ȃ錟�����K�v�ł���B �E����̓H��Ȑ��̎��̃X�e�b�v�Ƃ��āC�u���a�H��v������B�\�������̒i�K�ł͗ǂ����ʂ������Ă��邽�߁C���̂��Ƃɂ��Ă��������d�˂����B �������������������w�Z �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@���@�@��Y�@���� |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@