【教科・単元】
化学Ⅰ「化学反応式と量的関係」
【実験の問題点】
教科書に炭酸カルシウムと塩酸を用いた類似の実験例があるが,実際に行うと,実験自体はもちろんデータ処理に時間がかかる。また,反応溶液が濁るため反応の様子がわかりにくい。
【実験のポイントと工夫】
できるだけ短時間で実験できるように,また正しいデータが得られるように実験方法を検討した。
ポイント① 実験手順説明とデータ処理でコンピュータを活用。
ポイント② 反応を見やすくするために,炭酸水素ナトリウムと硫酸の反応を利用。また,反応後の二酸化炭素を追い出すのに,エアーポンプを利用。
【準備】
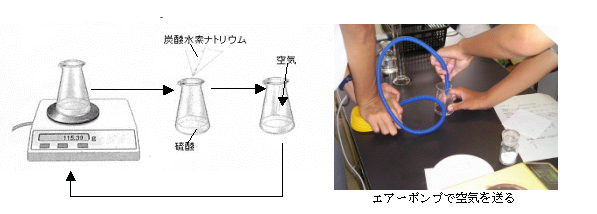
試薬等:重曹(炭酸水素ナトリウム) 硫酸(1.0mol/L 20mL)
器具等:薬さじ コニカルビーカー 薬包紙 エアーポンプ(ふいご) 電子てんびん
【手順】
① 各班ごとに炭酸水素ナトリウムを薬包紙にはかり用意する。

② 硫酸(1.0mol/l 20ml)が入れてあるコニカルビーカー全体の質量をはかる。
③ 炭酸水素ナトリウムを,コニカルビーカー内の硫酸に少しずつ入れる。
④ 反応が終わったら,エアーポンプでコニカルビーカー内に空気を送り,発生した二酸化炭素を完全に吹き出す。
⑤ 反応終了後のコニカルビーカー全体の質量をはかる。
⑥ 各班の結果をまとめる。
【授業の流れ】


【結果】
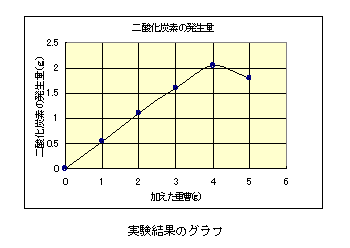
実際に実験を行うと,重曹は3.0gまでは完全に反応しコニカルビーカー内の溶液は透明になる。4.0g以上では未反応の重曹がはっきりした沈殿として残る。反応の様子や重曹の過不足が生徒にも非常によく分かったようである。グラフでは5.0gの二酸化炭素の発生量が少なく出ているが,これはこの班だけ読取精度が1gの電子てんびんだったため,誤差がかなり大きかったと思われる。(後日実験をやり直したときは4.0gの班とほぼ同じ値であった。)
【考察・感想】
この実験は,物質量・化学反応式の意味・モル濃度を一通り,学習し終わってから実施した。化学反応式の意味を学習する時間に実施ということも考えたが,どうしても硫酸も計算に含めた方が効果的だと判断したので,モル濃度の学習後に実施した。これらの値を用いて計算をすると,ほぼ理論どおりの化学反応式の係数が得られた。そのためか,生徒は納得して関心を持ってくれたようである。
(鹿児島県立加世田高等学校 教諭 内野孝一郎)