【教科・単元】
化学Ⅰ「酸化と還元」
【実験の問題点1】
電気分解の実験では,電極として白金板または炭素棒を用いる。白金板は高価であり,炭素棒でも1本200円以上である。生徒実験を行うために,身近で安価な電極材料はないか。
【電極材料の工夫】
炭素棒の代用として,シャープペンシルの芯を用いた。
【準備】
5%塩化銅(Ⅱ)水溶液,シャープペンシルの芯,単1形乾電池,電池ソケット,ワニ口クリップ,電極ホルダー
【実験】
簡易的な電気分解装置を作製し,電気分解を行う。
【結果】

【実験の問題点2】
塩化ナトリウム水溶液にフェノールフタレインを加え,電気分解すると,陰極付近が赤変する。しばらくすると,拡散のため溶液全体が赤くなってしまう。また,ヨウ化カリウム水溶液にデンプン溶液を加え電解すると,陽極付近が青紫色になる。この場合もしばらくすると溶液全体が着色してしまう。各極付近の変化の様子を明確にできないか。
【電極間の仕切りの工夫】
台所用スポンジを適当な大きさに切って仕切りを入れると効果的である。スポンジの代わりにろ紙でも十分である。
【準備】
5%塩化ナトリウム水溶液,5%ヨウ化カリウム水溶液,フェノールフタレイン溶液,1%デンプン溶液,シャープペンシルの芯,単1形乾電池,電池ソケット,ワニ口クリップ,電極ホルダー
【実験】
ろ紙で仕切りをした水溶液をシャープペンシルの芯を電極として電気分解する。
【結果】

【実験の問題点3】
アルミナを融解塩電解してアルミニウム単体を得る方法は,実験室で簡単に確認することは難しい。融解塩電解についての理解を深めるために,実験室で簡単に融解塩電解を行うための適当な材料はないか。
【)融解塩電解での材料の工夫】
材料として酢酸鉛(Ⅱ)三水和物を使用した。これは,イオン結晶の中で融点が75℃と低く,融解後もすぐに凝固せず,しばらくは液体の状態を維持している。
【準備】
酢酸鉛(Ⅱ)三水和物,ガラス棒,シャープペンシルの芯,単1形乾電池,電池ソケット,ワニ口クリップ,金網,電極ホルダー,三脚,ガスバーナー,マッチ
【実験】
酢酸鉛(Ⅱ)三水和物の結晶を加熱融解して電気分解する。
【結果】

しばらくすると陰極に鉛が析出してくる様子がはっきりと観察できる。
【授業の流れ】
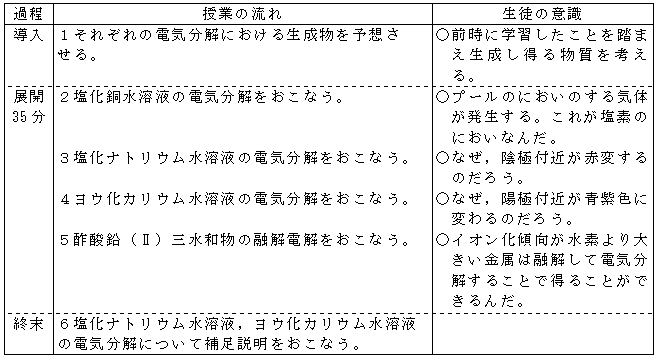
【生徒の感想】
①塩化銅(Ⅱ)水溶液の電気分解では,陽極から塩素が発生し,陰極には銅が析出していることがよく分かった。
②陽極から発生した気体のにおいは「カルキのにおい」だ。
③塩化ナトリウム水溶液の電気分解で陰極が赤変するのがよく分かった。
④融解塩電解とはどういうことなのか理解できた。 など
【実験を通しての感想・課題】
感想
①電極にペンシルの芯を用いることで多くのセットを用意できた。
②塩化ナトリウム水溶液の電気分解で陰極が赤変するのがよく観察できた。
③でんぷん溶液を加えたヨウ化カリウム水溶液の電気分解は,入試問題でも良く取り上げられる。陽極付近の変色について考えさせる良い材料となる。
④融解塩電解とはどういうことなのかよく理解できたようである。
課題
①塩化ナトリウム水溶液の電気分解では,陽極で塩素が,陰極で水素が発生する。しかし,この装置では発生している気体のにおいが,塩素によるものなのか,水素によるものなのかをはっきり区別できない。
②酢酸鉛(Ⅱ)水溶液をペンシル電極を用いて電気分解しても陰極に鉛が析出した。イオン化傾向が水素に近いためだと考えられるが,生徒が混乱する可能性もある。融解塩電解の材料として使用できるものが他にないだろうか。
③ファラデーの法則に関する定量的な取り扱いができる実験方法はないだろうか。
(鹿児島県立錦江湾高等学校 教諭 米満敏朗)