【教科・単元】
化学Ⅰ「物質の成分」
【観察,実験の問題点】
炎色反応とは,金属成分が炎の中で熱せられ独特の色を出す反応である。教科書ではきれいな白金線に試料を付け,ガスバーナーの外炎の中にさし込む方法が紹介されているが,次のような問題点がある。
(1)白金線は高価であり,生徒数分準備するには経費的に困難である。
(2)反応時間が短く,炎の色を十分観察できない場合がある。
【観察,実験の工夫】
(1)材料の工夫
白金線の代わりに,「綿」を使用した。綿は安価で,手に入りやすく,セルロースの網目状構造により,金属塩の水溶液を吸収しやすい。
(2)観察のための工夫
綿はそれ自身が燃えやすいため黄色の炎が出てくる。この対策として,試料として1mol/Lの水溶液とメタノールを約1:1の比で混ぜた混合溶液を使用することにした。これにより,綿自身が燃えるタイミングを遅らせることができるので,炎色反応を観察する時間が確保できる。
【準備】
綿,ピンセット(大),バーナー,蒸発皿,ビーカー100mL,濃塩酸,蒸留水,メタノール
塩化リチウム,塩化ナトリウム,塩化カリウム,塩化バリウム,塩化銅(Ⅱ)の各1mol/L水溶液
【手順】
①ビーカーに少量の濃塩酸と約50mLの蒸留水を別々に入れる。ピンセットを濃塩酸につけて洗浄し,バーナーの外炎でよく焼く。炎に色が付いている場合は,蒸留水のビーカーで冷やした後,再び濃塩酸で洗浄する。炎の色が付かなくなるまで,この操作を繰り返す。
②次に各水溶液を蒸発皿に少量とり,さらに約同量のメタノールを加える。洗浄したピンセットに,小指の爪先大の綿をよく固めてはさみ,蒸発皿の混合溶液を染み込ませる。
③液を染み込ませた綿をバーナーの外炎中に入れ,炎の色を観察する。
④未知の試料で炎色反応の実験を行い,含まれる元素を推定する。
【授業の流れ】


【生徒の感想】
炎色反応で元素の確認ができることが分かった。
元素によっていろいろな色がでるのが不思議だった。
色の違いが分かりにくいものがあり判断が難しいと思った。
先生がやった実験は,迫力があっておもしろかった。 など
【演示実験の方法】
①試験管に塩素酸カリウム2.5gと塩化リチウムなど(銅を除く)の塩を0.5g加える。
②試験管ばさみで試験管の上部を持ち,中火のバーナーの炎で直接加熱する。
③1分ほどで融解するが,さらに加熱して泡が立ってきたら加熱を止め,即座に米粒大の硫黄の固体(粉末も可)を入れる。
④入れるとすぐに硫黄に火がつき花火のようなまばゆいばかりの炎色反応が楽しめる。
[参考]楽しむ化学実験東京理科大学サイエンス夢工房朝倉書店
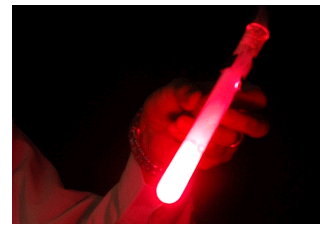
【考察・感想】
白金線を用いる場合に比べて,ある程度の時間炎色を観察できるので,生徒は興味を持って取り組んでいた。
(鹿児島県立高山高等学校 四角目昇一)